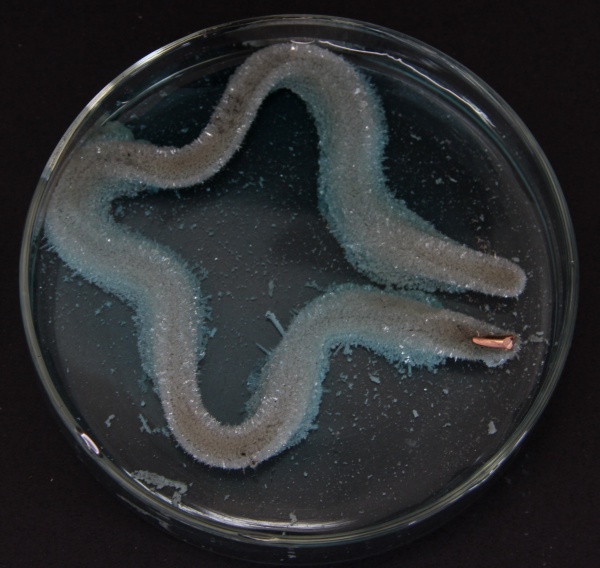
Ao se colocar uma peça de cobre dentro de uma solução de nitrato de prata, teremos uma reação eletroquímica com a consequente deposição de prata metálica que ocorre sobre o cobre ainda existente.
Sendo resumida na seguinte reação
2 AgNO3 + Cu → Cu(NO3)2 + 2 Ag
No caso da fotografia acima o material utilizado foi uma moeda de cobre.
A reação pode ser interpretada observando a série eletroquímica, na qual percebe-se que a prata é o metal mais nobre, com maior tendência a sofrer uma redução, em relação ao cobre.
Imagem em licença Creative Commons (by-nc-nd 2.0). O que significa que pode utilizar livremente a imagem desde que compartilhe na mesma licença, para fins não lucrativos e cite a fonte original. Via emmcnamee.
Texto escrito por Prof. Dr. Luís Roberto Brudna Holzle (luisbrudna@gmail.com ).